Bateria Caseira
Bateria Caseira
Colégio Estadual Professor Edilson Souto Freire
Dias d'Ávila
Adoniram Estrela
Alexandre Batista
Anthony Lucas
Iasmin Silva
Isabela Fernandes
Islan Ribeiro
Leonardo Normando
Luana Beatriz
Rafael Vinicius
Suellen Câmara
Vinícius Lima
Alexandre Batista
Anthony Lucas
Iasmin Silva
Isabela Fernandes
Islan Ribeiro
Leonardo Normando
Luana Beatriz
Rafael Vinicius
Suellen Câmara
Vinícius Lima
Resumo:
Em decorrência de um experimento relacionado as matérias de física e química, elaboramos um projeto experimental que resume-se em uma bateria caseira. Utilizando de materiais que podem ser facilmente encontrados para gerar energia elétrica através de uma reação química. A tensão elétrica (medida em volts) obteve variações de acordo com cada teste realizado, pois além de ocorrerem mudanças nas substâncias químicas usadas na formação de cada bateria o tempo esperado para a diluição das substâncias também obteve variações.
Palavras-chave: experimento,
física, bateria.
Introdução:
Para a compreensão dos experimentos
realizados e transcritos aqui é necessário que tenhamos uma noção básica do que
ocorre em uma bateria, isso envolve desde o sentido real e o sentido convencional
dos elétrons até a oxirredução dos átomos e sua força eletromotriz. Então,
vamos conceituar brevemente o que são cada um desses termos.
Em 1791 um anatomista italiano chamado Luigi Galvani publicou uma pesquisa que afirmava que quando dois metais diferentes entram em contato com uma rã dissecada a musculatura da coxa do animal sofre contrações, defendendo assim a teoria da “eletricidade animal” que acreditava que os músculos da rã armazenavam energia enquanto os metais eram os condutores desta. No entanto, essa teoria não agradou o físico italiano Alessandro Volta que, desacreditado de tais afirmações, propôs-se a recriar a experiência de Galvani e repetiu uma série de experimentos assim utilizando metais distintos na tentativa de provar que a teoria da “eletricidade animal” estava incorreta.
Durante seus experimentos ele
constatou que na presença de metais iguais as contrações não ocorriam, porém
surgiam quando esses metais eram diferentes, revelando assim que o que
provocava a eletricidade era na verdade dois metais diferentes em contato com
um condutor, este sendo a rã.
Para provar que estava correto, Volta fez um circuito formado por uma solução eletrolítica, ou seja, uma solução com íons dissolvidos, que ele chamava de condutor úmido ou condutor de segunda classe, colocados em contato com dois eletrodos metálicos. Esses últimos, Alessandro Volta designava de condutores secos ou condutores de primeira classe. Ele fez isso por colocar um condutor úmido (que era uma solução aquosa salina) entre dois condutores secos (que eram metais ligados por um fio condutor). Nesse momento ele observou que se despertava o fluxo elétrico. Ele passou a entender também que dependendo dos metais que ele utilizava, o fluxo da corrente poderia ser maior ou menor. [1]
[Pilha de Volta] Volta criou a primeira pilha elétrica em 1800 que passou a ser chamada de Pilha de Volta, Pilha Galvânica ou Pilha Voltaica e, ainda, “rosário”. É formada por discos intercalados de dois metais diferentes. Por exemplo, são colocados um disco de prata, um disco de zinco por cima e um disco de papelão embebido em uma solução de salmoura. Continua realizando essa montagem intercalada: disco de prata/ disco de zinco/disco umedecido até formar uma coluna alta, mas que consegue se sustentar; por último, as extremidades da pilha são ligadas com um fio condutor externo. Assim, esse dispositivo recebeu esse nome porque realmente era uma “pilha”, isto é, discos empilhados formando uma coluna. Os discos de metais foram denominados por Volta de condutores secos ou de primeira classe, enquanto o embebido em salmoura foi denominado de condutor úmido ou de segunda classe. Esse experimento causou reviravoltas no mundo científico e a partir daí todos os aparelhos que produziam eletricidade a partir de processos químicos (ou seja, que produziam energia química em energia elétrica) passaram a ser chamados de celas voltaicas, pilhas galvânicas ou, simplesmente, pilhas. [2]
Corrente elétrica
A corrente elétrica é a
movimentação de elétrons de forma ordenada, buscando restabelecer o equilíbrio
desfeito pela ação de um campo elétrico ou outros meios. Sua unidade padrão no
Sistema Internacional (SI) para medida da intensidade da corrente é
dada em ampère (A). Ela pode ocorrer tanto em condutores sólidos quanto em
gases e líquidos ionizados.
Ionização é um processo químico mediante ao qual se produzem íons, espécies químicas eletricamente carregadas, pela perda ou ganho de elétrons a partir de átomos ou moléculas neutras. [3]
Para
criarmos uma corrente elétrica produzida em um fio condutor, por exemplo, é
necessário criar um campo elétrico nesse condutor e nele teremos diferentes
níveis de energia potencial.
O campo elétrico designa o local onde as forças elétricas estão concentradas por meio da ação das cargas elétricas puntiformes (corpo eletrizado cujas dimensões e massa são desprezíveis se comparadas às distâncias que o afastam de outros corpos eletrizados). Dessa forma, o campo elétrico é um tipo de força em que as cargas elétricas geram ao seu redor; trata-se de uma grandeza vetorial, ou seja, possui módulo, direção e sentido, donde as cargas elétricas que se aproximam (elétrons, prótons ou íons) estão sujeitas às forças de interação: seja de atração ou de repulsão. [4] O potencial elétrico ou potencial eletrostático de um ponto em relação a um ponto de referência, é definido pelo trabalho da força elétrica sobre uma carga eletrizada no deslocamento entre esses dois pontos. [5]
São
esses mesmos níveis diferentes de energia potencial que provocarão a DDP
(diferença de potencial), ou simplesmente tensão elétrica. Em uma pilha
existem dois polos, o positivo e o negativo, sendo o positivo (que perde
elétrons) o polo com maior potencial elétrico e o negativo (que ganha elétrons)
o polo com menor potencial elétrico. Sendo assim, o movimento dos elétrons será
sempre no sentido do polo com maior potencial. Além de sua função ser uma fonte
de energia elétrica uma pilha também mantêm a diferença de potencial, mantendo
ativo o movimento ordenado dos elétrons.
Tensão Elétrica
De maneira resumida, pode-se
dizer que a tensão elétrica é a força empregada nos elétrons para que eles se
movimentem. Ela é também conhecida como DDP (diferença de potencial), pois só
há uma tensão elétrica onde ocorre a diferença de potencial elétrico, ou seja,
sempre que houver potenciais elétricos diferentes haverá o movimento de elétrons,
consequentemente a tensão elétrica.
Sentido Real e Sentido
Convencional
Há muito tempo os estudos da
ciência apontavam que em uma corrente elétrica eram as partículas positivas que
se moviam do potencial positivo para o negativo, sendo assim todos os cálculos,
teorias e especulações eram baseados nessa consideração. Após estudos mais
profundos sobre os átomos revelou-se que na realidade o que ocorre é o oposto.
São as partículas negativas que se movem e sempre de um potencial negativo para
o positivo.
 |
| [Sentido real e convencional da corrente] |
A ideia de que a corrente parte sempre do meio positivo para o negativo já havia se enraizado e de certa forma não interferia no cálculo nem na análise da corrente, portanto foi-se decidido permanecer com essa lógica, que posteriormente passou a ser chamada de sentido convencional. Já o sentido real de uma corrente elétrica está voltado ao movimento das partículas negativas em direção ao potencial positivo.
Força Eletromotriz
A força eletromotriz em uma
pilha representa a pressão que move os elétrons através do circuito externo. Ela
é a diferença de potencial entre os polos de uma bateria ou gerador antes da
ligação de qualquer carga. É medida em volts com o auxílio de um voltímetro.
Com a F.E.M podemos calcular a energia fornecida ao circuito durante certo
tempo. Para calcular
a força eletromotriz de uma pilha é utilizado a equação de Nernst, desenvolvida por um químico e físico alemão chamado Walter Nernst.
Equação do gerador
Geradores
elétricos são dispositivos usados para a conversão de determinada energia em
energia elétrica, como é o caso das baterias e das usinas hidrelétricas.
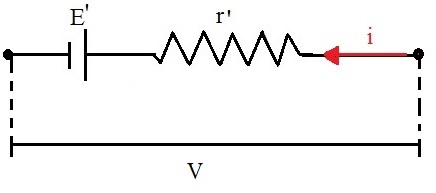 | |
| [Representação do gerador elétrico] |
E = Força eletromotriz (volts)
r = Resistência interna do gerador (Ohms)
i = Corrente elétrica
V = Tensão útil (volts)
Pelo fato de os geradores serem fabricados com materiais condutores, eles apresentam uma resistência interna, portanto parte da energia elétrica que produzem é transformada em energia térmica (efeito Joule) em seu interior. Dessa forma, dizemos que a resistência interna é característica própria dos geradores. Em alguns geradores, como pilhas e baterias, sua resistência interna tende a aumentar, à medida que são utilizados. Por outro lado, se fosse construído um gerador elétrico ideal, ele não teria resistência interna, portanto não haveria perda de energia elétrica através do efeito Joule em seu interior.[8]
 | ||
| [Fórmula] |
Exemplo:
E = 24 V
r = 3 Ohms
i = 2.0 A
U = E - r x i
U = 24 - 3 x 2
U = 24 - 6
U = 18 V
Oxirredução
A oxidação é o processo onde
há uma perda de elétrons, enquanto a redução é o processo onde ocorre o
inverso; ganho de elétrons. Já a oxirredução é uma simultânea troca de elétrons
entre os processos opostos de oxidação e redução, ou seja, enquanto um íon ou
átomo perde elétrons (sofrendo oxidação), um outro íon ou átomo ganha estes mesmos
elétrons (sofrendo redução).
Multímetro
O multímetro é um aparelho que mede diferentes grandezas elétricas. Existem dois tipos de multímetro, o analógico e o digital. No multímetro analógico a leitura ocorre através da força eletromagnética exercida em seu ponteiro, já no multímetro digital a leitura ocorre através do amplificador operacional.
Multímetro
O multímetro é um aparelho que mede diferentes grandezas elétricas. Existem dois tipos de multímetro, o analógico e o digital. No multímetro analógico a leitura ocorre através da força eletromagnética exercida em seu ponteiro, já no multímetro digital a leitura ocorre através do amplificador operacional.
Um amplificador operacional é um circuito integrado amplificador, com um ganho elevado, seu diferencial é que ele tem duas entradas, uma inversora negativa e outra não inversora positiva, a tensão de sua única saída é o resultado da diferença entre as entradas inversora e não inversora multiplicado pelo ganho. [9]
 |
| [Multímetro] |
As grandezas elétricas são medidas através das pontas de prova,
de cor vermelha (negativo) e preto (positivo) que são inseridos nos
objetos (corpos) em questão. A medição deve ser programada para que o multímetro marque o resultado desejado.
- A corrente elétrica é medida em Amperes (A);
- A resistência elétrica é medida em Ohms (Ω);
- A tensão elétrica é medida em Volts (V);
- A frequência é medida em Hertz (Hz);
- A capacitância é medida em Microfarads (μF);
- A temperatura é medida em Graus Celsius (C°);
Resultados e Discussão:
[Primeiro teste]
Os materiais utilizados para
a primeira sessão de testes foram:
- 1 lata de alumínio;
- 1,60 m (um metro e sessenta) de fio de cobre;
- 1 lixa;
- Papel toalha;
- Água (H2O);
- Sal;
- Água sanitária;
- Parafusos;
- 6 Copos de plásticos;
- Multímetro;
Primeiro procedimento:
Primeiramente, a lata de
alumínio foi lixada por dentro e por fora, e em seguida o fio de cobre foi
descascado por completo. Foram feitos dois furos paralelos na parte superior da
lata, próximo a borda. O fio de cobre (bom condutor elétrico) foi envolto em um
bolo de papel toalha enrolado em formato cilíndrico deixando apenas uma pequena
ponta e envolvendo o restante sob mais papel toalha para impossibilitar que
futuramente o cobre entrasse em contato com o alumínio.
Como substâncias para a
reação química foram utilizados 1/3 de água sanitária (catalisador) para 2/3 de
água, gerando imediatamente 1.25 V. Após o tempo de espera estimado de
cinco a dez minutos, foi medida sua tensão elétrica novamente, resultando em
1.33 V. Por meio deste chegamos à conclusão de que quanto maior a
quantidade de tempo submetido aos compostos, maior a diluição dessas
substâncias, o que aumentará sua voltagem.
Segundo procedimento:
Foi repetido o mesmo
processo anterior, modificando apenas as substâncias usadas. A água foi
substituída por algumas colheres de sal e após medirmos o resultado foi o
alcance de 1.60 e 1.65 V. Por tal motivo preferimos optar pela utilização
dessas substâncias.
Terceiro procedimento:
Para substituir a lata de
alumínio foram utilizados seis copos de mesma medida. Adicionamos água, água
sanitária e sal e enrolamos pedaços de tamanhos similares do fio de cobre em
parafusos que foram postos dentro da solução. Uma ponta do fio de cobre ficou
propositalmente ligada ao copo seguinte, até o último copo, no qual uma ponta
ficou para fora da solução. Após as devidas medições com o voltímetro os
resultados foram de 1.25 e 1.27 V.
Ao repetirmos os
procedimentos com apenas água e água sanitária obtivemos apenas 1.21 volts. E
por último com a mistura de água sanitária e sal avançamos para 1.72 e 2.25
V.
OBS: Em um experimento
realizado em sala contendo como substâncias água sanitária, sal e água
observamos que a marcação indicou 1.01 V.
[Segundo teste]
Os materiais utilizados para
a segunda sessão de testes foram:
- 3 fios de cobre;
- 3 placas de alumínio;
- Água sanitária;
- Água (H2O);
- Multímetro;
Primeiro procedimento:
Neste procedimento foram
utilizados 125 ml de água sanitária e 250 ml de água na solução química, ou
seja, 2/3 de água para 1/3 de água sanitária. Em um pote plástico posicionamos
três placas de alumínio, duas sobrepostas ao redor do pote e a última
verticalmente dentro deste. Os dois furos foram feitos paralelamente na parte
superior do recipiente, local que utilizamos para a passagem do fio de cobre
contorcido e no mesmo local adicionamos mais um fio de cobre. Por fim foi
adicionado a solução química (água e água sanitária) e aguardamos cerca de dez
minutos o processo de oxirredução ser feito. Após isso a bateria foi medida com
o auxílio de um voltímetro, e entre as variáveis foi gerado 1.71 V.
Segundo procedimento:
O mesmo procedimento
anterior foi feito, exceto pela quantidade de água sanitária na solução
química, que foi de 375 para 187,5. Inicialmente a solução gerou 1.50 V e
após dez minutos deixado no processo de oxirredução gerou 1.78 V.
Terceiro procedimento:
Neste último procedimento,
foram utilizadas duas colheres de sopa de sal. Tendo a água e o sal como
substâncias em um volume de 350. Ao misturarmos a solução e deixarmos no
processo de oxirredução por dez minutos obtemos 0.78 V.
Os materiais utilizados para a realização do experimento foram:
[Terceiro Teste]
Os materiais utilizados para a terceira sessão de
testes foram:
- 3 tubos de PVC (15 cm cada);
- 3 placas de alumínio;
- 1 pote plástico;
- Água sanitária;
- Água (H2O);
- 3 fios de cobre;
- Barbante;
- Multímetro;
[Primeiro procedimento]
Neste procedimento foram utilizados 50ml de água
sanitária e 50 ml de água na solução que foi armazenada em um pote plástico
comum. Após aguardarmos cerca de dez minutos a oxirredução das substâncias
medimos a tensão elétrica da pilha através do multímetro. Apesar das variáveis
o resultado foi de 1.8 a 1.9 V.
[Segundo procedimento]
O mesmo procedimento que o anterior foi feito,
mudando apenas a quantidade de água sanitária adicionada na solução química. Após
10 minutos de espera gerou-se aproximadamente 2.4 V.
[Terceiro procedimento]
Utilizamos três tubos de PVC de 15 cm cada, onde
encaixamos dentro de cada um deles uma placa de alumínio. As placas foram
usadas para forrar a parte interna dos tubos, deixando apenas a superfície
inferior e a tampa livres. No encaixe superior foram feitos dois furos, um ao
centro para que houvesse passagem para o fio de cobre e o outro mais próximo de
uma das extremidades onde ocorreria a passagem do alumínio.
Para a parte interna da bateria caseira o fio de
cobre foi envolto por camadas de barbante para que não houvesse contato direto
do cobre com o alumínio, servindo como uma espécie de isolante. Já a parte externa
da bateria revelava no centro um fio de cobre descascado e exposto e mais na
extremidade uma ponta da placa de alumínio. Finalizada a montagem, passamos
para a solução química.
Foram adicionados 100 ml de água em cada uma das três
baterias, até que o líquido se aproximasse da borda e enfim encaixamos a tampa
superior nas baterias. Dez minutos se passaram a espera do processo de
oxirredução das substâncias e então medimos a tensão elétrica da bateria, que
gerou cerca de 3.0 a 3.2 V.
[Experimento]
[Experimento]
Os materiais utilizados para a realização do experimento foram:
- 4 tubos de PVC (15 cm cada);
- 4 placas de alumínio;
- 1 tubo de barbante;
- 400 ml de água sanitária;
- 5 fios de cobre;
- 1 multímetro;
- 2 garras de jacaré;
Para a realização do experimento, primeiramente descascamos os fios de cobre. Após isso passamos a montar a estrutura da bateria. Cada tubo de PVC foi revestido internamente com placas de alumínio, deixando exposto apenas a base de cada um e suas tampas.
 |
| [Estrutura da bateria] |
Ainda na estrutura da bateria, foram feitos dois furos em cada encaixe superior, um para a passagem do fio de cobre e outro para a passagem de uma ponta de alumínio.
Passando para as substâncias que iriam ser usadas na reação química, optamos por usar apenas água sanitária. Foram adicionados 100 ml da solução em cada tubo de PVC.
Como durante o processo de geração de energia não pode haver o contato direto entre o alumínio e o cobre foi necessário revestir boa parte de cada fio com bastante barbante justamente para nos certificarmos que não haveria contato entre os dois metais condutores, deixando exposto apenas a parte que ficaria externamente nas pilhas.
Tendo isso, apenas encaixamos as tampas em seus devidos tubos, deixando em cada um respectivamente uma ponta de alumínio e outra de cobre.
A essa altura as baterias já estavam praticamente prontas, o necessário era somente ligá-las umas as outras com as garras de jacaré, lembrando-se que durante a ligação deve sempre ser um polo positivo ligado a um polo negativo. O polo positivo das nossas baterias será o cobre, enquanto o negativo será o alumínio, ou seja, o cobre da primeira bateria deve ser ligado ao alumínio da segunda bateria e assim sucessivamente. Vale lembrar que não se deve ligar o polo que sobrar na última bateria no polo que sobrar da primeira, caso contrário haverá um curto-circuito o que acabará com as baterias no exato momento.
 |
| [Bateria] |
OBS: Como não havia garras de jacaré suficientes usamos um outro fio de cobre para ligar a terceira bateria na quarta.
O resultado obtido com as quatro baterias foi de 6.2 V.
Resolvemos então ser mais abrangentes e calculamos a resistência interna da bateria caseira com os seguintes dados:
E = 6.2 V
r x i = 5.1 V
U = 0.1 V
U = 0.1 V
i = 16.3 mA
Calculamos:
E = U + r x i
6.2 = 0.1 = 5.1
r x 16.3 / 1000 = 5.1
5.1 x 1000 / 16.3 =
r = 312,9 Ohms
A resistência interna da nossa bateria caseira é de 312,9 Ohms.
Conclusão:
Resultados do primeiro
teste:
Na lata de alumínio os
resultados variam entre:
- 1.25 V
- 1.30 V
- 1.33 V
- 1.60 V
- 1.65 V
Nos copos plásticos a variação
é de:
- 1.21 V
- 1.40 V
- 1.72 V
- 2.25 V
Ou seja, a água sanitária e
o sal se mostraram mais propícios para a construção da bateria, pois produzem
mais volts, assim como a lata que é um bom condutor. O nível alto que o último procedimento nos deu chamou nossa atenção, porém só foi possível por conter uma serie de baterias ligadas entre si formando um circuito, o que no entanto não era tão compacto quanto as demais pilhas.
Resultados do segundo teste:
Na solução com água
sanitária e água foi gerado:
- 1.71 V (após 10 minutos).
Na solução com água
sanitária foram gerados:
- 1.50 V
- 1.78 V (após 10 minutos).
Na solução com água e sal
foi gerado:
- 0.78 V (após 10 minutos).
Concluímos portanto que a
água sanitária se mostrou a substância mais eficiente nesse teste.
Resultados do terceiro teste:
Nos potes
plásticos foram gerados:
- 1.8 V
- 1.9 V
- 2.4 V
Nas baterias
com tubo de PVC foram gerados:
- 3.0 V
- 3.2 V
Resultados do experimento:
- E = 6.2 V
- r x i = 5.1 V
- U = 0.1 V
- i = 16.3 mA
- r = 312,9 Ohms
Apesar das variáveis e de algumas falhas obtidas em algumas tentativas que não foram relatadas neste blog, todos os testes feitos até chegarmos no experimento final foram úteis para o nosso progresso educacional, onde tivemos que abandonar nossa zona de conforto e trabalhar para fazer com que este experimento desse resultados satisfatórios. As pesquisas elaboradas para a realização deste experimento e até mesmo a realização dele nos fez expandir nosso conhecimento nas áreas de física e química e até compreender que cada ciência está interligada de alguma forma.
Referências:
[1]http://blogm301.wixsite.com/revistalemoscunha/single-post/2016/10/25/Hist%C3%B3ria-e-Evolu%C3%A7%C3%A3o-da-pilha-de-Alessandro-Volta-%C3%A0s-baterias-de-%C3%ADon-l%C3%ADtio
[2]http://blogm301.wixsite.com/revistalemoscunha/single-post/2016/10/25/Hist%C3%B3ria-e-Evolu%C3%A7%C3%A3o-da-pilha-de-Alessandro-Volta-%C3%A0s-baterias-de-%C3%ADon-l%C3%ADtio
[3]https://pt.wikipedia.org/wiki/Ioniza%C3%A7%C3%A3o
[4]https://www.todamateria.com.br/campo-eletrico/
[5]https://www.todamateria.com.br/potencial-eletrico/
[6]https://www.infoescola.com/fisica/tensao-eletrica/
[7]https://pt.wikipedia.org/wiki/Tens%C3%A3o_el%C3%A9trica
[8]http://mundoeducacao.bol.uol.com.br/fisica/equacao-gerador.htm
[9]http://blog.novaeletronica.com.br/o-que-e-um-amplificador-operacional/
https://educacao.uol.com.br/disciplinas/fisica/corrente-eletrica-o-movimento-ordenado-de-eletrons-em-condutores.htm
[2]http://blogm301.wixsite.com/revistalemoscunha/single-post/2016/10/25/Hist%C3%B3ria-e-Evolu%C3%A7%C3%A3o-da-pilha-de-Alessandro-Volta-%C3%A0s-baterias-de-%C3%ADon-l%C3%ADtio
[3]https://pt.wikipedia.org/wiki/Ioniza%C3%A7%C3%A3o
[4]https://www.todamateria.com.br/campo-eletrico/
[5]https://www.todamateria.com.br/potencial-eletrico/
[6]https://www.infoescola.com/fisica/tensao-eletrica/
[7]https://pt.wikipedia.org/wiki/Tens%C3%A3o_el%C3%A9trica
[8]http://mundoeducacao.bol.uol.com.br/fisica/equacao-gerador.htm
[9]http://blog.novaeletronica.com.br/o-que-e-um-amplificador-operacional/
https://educacao.uol.com.br/disciplinas/fisica/corrente-eletrica-o-movimento-ordenado-de-eletrons-em-condutores.htm




Comentários
Postar um comentário